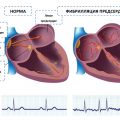
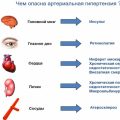
Тахикардия — это состояние, при котором человеческому сердцу характерен повышенный пульс, превышающий норму на 30 ударов в минуту. В большинстве случаев тахикардию сопровождают неприятные ощущения, такие как сердцебиение, давление в груди, вялость и головокружение. Одним из наиболее популярных средств, использование которого рекомендуется при тахикардии, является препарат Валидол.
Валидол — это комбинированное лекарственное средство, основным действующим веществом которого является ментол. Препарат имеет спазмолитическое, обезболивающее и седативное действие на организм, благодаря чему он эффективно справляется с неприятными симптомами тахикардии. Оказывая расслабляющий эффект на гладкую мускулатуру, Валидол способствует снижению пульса и успокаивает нервную систему. При этом, препарат не является противоаритмическим средством и не регулирует ритм сердца, а лишь устраняет неприятные ощущения и помогает справиться с нервным напряжением.
Правильное использование Валидола при тахикардии заключается в медленном рассасывании таблетки, разрешенной препаратом дозы, под языком. Обычно рекомендуется принимать по 1-2 таблетки до 3 раз в день при необходимости. Однако, перед применением препарата необходимо проконсультироваться с врачом, так как дозировка и режим приема могут варьироваться в зависимости от индивидуальных особенностей пациента и степени тахикардии.
Важно помнить, что Валидол — это лишь средство для временного облегчения симптомов тахикардии и не является основным методом лечения заболевания. При постоянной тахикардии следует обратиться к врачу для выяснения причин и назначения комплексного лечения.
Валидол для снижения пульса при тахикардии
Тахикардия — это состояние, при котором сердечный ритм увеличивается и превышает нормальные показатели. Оно может быть вызвано различными факторами, как физическими, так и эмоциональными.
Одним из способов снижения пульса при тахикардии является применение препарата Валидол. Валидол – это лекарственное средство, которое содержит эфир ментола и валидола. Оно имеет успокоительное, седативное и спазмолитическое действие, а также способствует расширению сосудов и снижению свертываемости крови.
Чтобы правильно применять Валидол при тахикардии, необходимо следовать следующим рекомендациям:
- Проконсультируйтесь с врачом. Перед началом применения Валидола важно проконсультироваться с квалифицированным врачом.
- Принимайте Валидол по предписанию врача. Дозировка Валидола зависит от индивидуальных особенностей пациента и тяжести тахикардии. Обычно рекомендуется употреблять по 1-2 таблетки 2-3 раза в день после еды.
- Не превышайте рекомендуемую дозу. Важно строго соблюдать рекомендации вашего врача и не превышать рекомендуемую дозировку. Превышение дозы может привести к побочным эффектам или серьезным проблемам со здоровьем.
- Принимайте Валидол правильно. Таблетки Валидола следует принимать полностью, запивая небольшим количеством воды. Не растворяйте или разжижайте таблетку перед применением.
- Соблюдайте режим приема. Чтобы достичь наилучшего результата, рекомендуется принимать Валидол регулярно в одно и то же время суток.
При приеме Валидола для снижения пульса при тахикардии рекомендуется обратить внимание на свое самочувствие и в случае возникновения побочных эффектов обратиться к врачу. Важно помнить, что Валидол может быть эффективным средством для снижения пульса при тахикардии, однако только врач может определить оптимальную дозировку и продолжительность лечения.
Процесс влияния Валидола на пульс
Валидол – это аллостерический модулятор нейрорецепторов, который оказывает успокоительное и вазодилатирующее действие. Действующее вещество препарата – ментиловый эфир изовалериановой кислоты – обладает спазмолитическим и седативным эффектом, способствует урчанию гладкой мускулатуры, приводя к расслаблению сосудистых стенок. Влияние Валидола на пульс при тахикардии состоит в уменьшении частоты сердечных сокращений и давления.
Препарат снижает возбудимость рецепторов сердца и судорожную активность миокарда, что способствует снижению сократимости сердца и упорядочению сокращений жизненно важного органа. В связи с этим, Валидол может быть использован как средство для лечения тахикардии.
Прием Валидола приводит к расслаблению сосудов, установлению нормального тонуса сосудистой системы и снижению сердечного выброса. В результате сердце начинает работать более эффективно, пульс становится более ровным и медленным.
Принимать Валидол следует по 1-2 таблетки под язык до полного рассасывания или в виде капель на сахар. Это облегчит и ускорит воздействие препарата на организм. Препарат рекомендуется принимать при первых признаках тахикардии или застоя крови, но предварительно необходимо проконсультироваться с врачом.
Нужно отметить, что Валидол является средством, облегчающим симптомы, и не лечит основное заболевание. Поэтому после устранения возникших проблем с сердцем необходимо обратиться к врачу для выявления и лечения причин тахикардии.
Как Валидол снижает частоту сердечных сокращений
Валидол – это лекарственное средство, имеющее седативное, противосудорожное и противоаритмическое действие. Его применяют для снижения частоты сердечных сокращений при тахикардии — состоянии, при котором сердце начинает биться очень быстро.
Действующим веществом Валидола является ментол. Это вещество основным образом влияет на сосудистую систему, снимая спазмы гладкой мускулатуры сосудов и расширяя их. В результате, кровь легче протекает по сосудам, что способствует снижению нагрузки на сердце и снижению его частоты сокращений.
Кроме сосудистого действия, Валидол оказывает и седативное действие. Ментол помогает снизить возбудимость нервной системы, в результате чего симпатическое воздействие на сердце ослабевает, и частота сердечных сокращений уменьшается.
Противоаритмическое действие Валидола обусловлено его способностью нейтрализовывать перекись кислорода и снижать оксидативный стресс в сердечной мышце. Таким образом, Валидол помогает восстановить нормальный ритм сердечных сокращений и снижает вероятность возникновения аритмий.
Правильное применение Валидола при тахикардии заключается в рассасывании таблеток под языком. Это позволяет активным веществам быстрее попасть в кровь и начать оказывать свое действие. Рекомендуется принимать 1-2 таблетки Валидола до 3 раз в день при необходимости.
Как правильно принимать Валидол
Валидол – препарат, который часто используется для снятия некоторых симптомов, включая нервное и сердечное напряжение. Он содержит вещество под названием Validol, которое является эфиром изовалериановой кислоты и ментола.
Как правило, Валидол принимают подъязычно, размещая таблетку под язык и держа ее там до полного рассасывания. Это позволяет активным веществам препарата быстро попасть в кровь через капилляры слизистой оболочки рта. Обычная дозировка составляет 1-2 таблетки при необходимости.
Преимущества принятия Валидола подъязычно:
- Быстрое проникновение веществ в кровь;
- Уменьшение времени ожидания эффекта;
- Удобство применения — таблетку всегда можно иметь под рукой и незаметно принять.
Валидол можно принимать по необходимости, но рекомендуется не превышать максимальную суточную дозу в 8 таблеток. Перед использованием Валидола рекомендуется проконсультироваться с врачом, особенно если у вас есть какие-либо сопутствующие заболевания или вы принимаете другие лекарственные препараты.
Валидол, как правило, хорошо переносится организмом, однако некоторые люди могут испытывать побочные эффекты, такие как покраснение кожи, сонливость или покалывание под языком. Если у вас возникли какие-либо необычные или неприятные ощущения после применения Валидола, стоит прекратить использование препарата и проконсультироваться с врачом.
Важно помнить, что Валидол является симптоматическим средством и не рекомендуется использовать его для самолечения. Если вы испытываете сердечные проблемы или серьезные симптомы, обратитесь к врачу для получения профессиональной помощи.
Важные аспекты при приеме Валидола
Валидол — это лекарственный препарат, который применяется для облегчения симптомов сердечно-сосудистых заболеваний и снятия неприятных ощущений в области сердца. При правильном применении Валидола можно значительно улучшить самочувствие и снизить пульс при тахикардии.
Вот несколько важных аспектов, которые стоит учитывать при приеме Валидола:
- Дозировка: Дозировка Валидола зависит от индивидуальных факторов, таких как возраст, вес, состояние здоровья. Обычно рекомендуется принимать 1-2 таблетки до или после еды не более 3 раз в день.
- Способ применения: Валидол принимается под язык и рассасывается. Это обеспечивает быстрое впитывание активных веществ и быстрый эффект.
- Продолжительность приема: Длительность приема Валидола может варьироваться в зависимости от состояния здоровья и рекомендаций врача. Обычно курс лечения составляет 2-3 недели.
- Побочные эффекты: Валидол обычно хорошо переносится организмом, однако иногда могут возникать нежелательные побочные эффекты, такие как аллергические реакции и тошнота. В случае любых неприятных симптомов рекомендуется проконсультироваться с врачом.
Важно помнить, что Валидол является симптоматическим средством и не решает основную причину тахикардии. При постоянных симптомах или неэффективности Валидола рекомендуется обратиться к квалифицированному врачу для диагностики и назначения соответствующего лечения.
Оптимальная дозировка Валидола
Дозировка Валидола должна быть выбрана в соответствии с индивидуальными особенностями пациента и рекомендациями врача. Обычно препарат применяется в виде таблеток, содержащих 20 мг активного вещества — ментола. Для достижения требуемого эффекта может потребоваться принятие разной дозировки препарата.
Основные рекомендации по дозировке Валидола:
- Обычная доза для взрослых — 1-2 таблетки, которые рекомендуется рассасывать в полости рта при первых признаках тахикардии.
- Для улучшения сонливости у детей до 12 лет рекомендуется применять 1/2 таблетки или использовать специальную детскую форму Валидола — капли.
- Детям старше 12 лет можно давать половину или целую таблетку Валидола по необходимости.
Важно помнить, что Валидол следует использовать только по назначению врача, так как самолечение может привести к нежелательным последствиям. Рекомендуется проконсультироваться с врачом о возможности применения Валидола, его оптимальной дозировке и продолжительности приема.
Перед началом применения Валидола необходимо тщательно изучить инструкцию по применению препарата, чтобы избежать возможных побочных эффектов и осложнений.
Вопрос-ответ:
Как Валидол влияет на пульс при тахикардии и как правильно принимать?
Валидол является препаратом, который оказывает седативное и спазмолитическое действие. Он может снижать пульс при тахикардии за счет улучшения кровоснабжения сердца и снижения нервного возбуждения. Правильная дозировка Валидола зависит от возраста и состояния пациента. Обычно рекомендуют принимать 1-2 таблетки 2-3 раза в день, продолжительность приема может быть от нескольких дней до нескольких недель. Но перед применением Валидола необходимо проконсультироваться с врачом, так как он может иметь противопоказания и побочные эффекты.
Помогает ли Валидол при тахикардии?
Да, Валидол может помочь при тахикардии, так как он обладает седативным и спазмолитическим действием. Он улучшает кровоснабжение сердца и снижает нервное возбуждение, что в свою очередь может привести к снижению пульса. Однако стоит помнить, что Валидол – это симптоматическое средство и не устраняет причину тахикардии. Поэтому, перед применением Валидола, необходимо проконсультироваться с врачом и уточнить возможность его применения в вашем случае.
Как правильно принимать Валидол при тахикардии?
Правильная дозировка Валидола зависит от возраста и состояния пациента. Обычно рекомендуют принимать 1-2 таблетки 2-3 раза в день. Продолжительность приема может быть от нескольких дней до нескольких недель. Валидол следует принимать после еды, рассасывая таблетку во рту. Однако перед применением Валидола необходимо проконсультироваться с врачом, так как он может иметь противопоказания и побочные эффекты.